Behandeling van Kahler
De ziekte van Kahler is een vorm van bloedkanker die veroorzaakt wordt door het ongecontroleerd en veelvuldig vermenigvuldigen van plasmacellen in het beenmerg. Plasmacellen zijn witte bloedcellen die een belangrijke rol spelen bij de bestrijding van ziekteverwekkers. De officiële naam van de ziekte van Kahler is multipel myeloom.
Behandeling van ziekte van Kahler
Na de diagnose ziekte van Kahler (of multipel myeloom) wordt er een behandelplan opgesteld. Dat gebeurt op grond van de richtlijn die de hematologen in de Myeloom werkgroep van de Stichting Hemato-oncologie voor volwassenen in Nederland (HOVON) gemaakt hebben.
Het uitgangspunt van de HOVON-richtlijn is dat je waar mogelijk in HOVON-studieverband behandeld wordt. Dit betekent dat zoveel mogelijk mensen meedoen aan klinische studies om behandelingen te optimaliseren. In deze klinische studies worden potentieel betere behandelingen vergeleken met de (tot nu toe) beste standaardtherapie. Het lot bepaalt of je in de groep wordt ingedeeld die de nieuwe behandeling krijgt of in de groep die de standaardtherapie krijgt.
Behandelproces van de ziekte van Kahler
Het is belangrijk je te realiseren dat er voor deze vorm van kanker veel verschillende behandelmogelijkheden zijn en je dus lang kunt leven met de ziekte. Hieronder bespreken we de eerstelijnsbehandelingen met of zonder stamceltransplantatie die in de richtlijn worden aanbevolen.
Als de ziekte van Kahler na de eerste behandeling terugkeert, kijk je opnieuw samen met je arts wat mogelijke nieuwe behandelopties zijn. Dit wordt tweedelijnsbehandeling genoemd. Er zijn veel middelen beschikbaar en er komen ook steeds meer nieuwe behandelingen bij. Ook lopen er klinische studies om nieuwe behandelingen te testen. Hierdoor zijn er veel mogelijkheden voor een volgende behandeling. Het doel is om het terugkomen van de ziekte met elke behandeling zo lang mogelijk uit te stellen.
Het behandelplan wordt vastgesteld in nauwe samenspraak tussen de behandelend hematoloog en jou als patiënt. Het behandelplan is belangrijk en het gesprek erover tussen behandelaar en patiënt is nog belangrijker. Realiseer je voortdurend dat het over jou gaat, dat je dus ook wat te zeggen en te beslissen hebt. Laat je goed informeren, stel vragen en laat de hematoloog niet weggaan voordat je een duidelijk beeld hebt van wat er komen gaat. En spreek anders af om er snel nog eens over te praten, zodat je erover kunt nadenken en er met anderen over kunt praten. Vaak heb je namelijk wat tijd om na te denken over wat je het liefst wil qua behandeling. In sommige gevallen is deze tijd er niet en kan het zijn dat je heel snel of zelfs direct moet beslissen. Dit is het geval als je ernstige symptomen of verschijnselen hebt.
Vragen die je bijvoorbeeld kunt stellen aan je arts zijn:
- Welke behandelingen zijn er voor mij?
- Wat zijn de bijwerkingen van deze behandeling?
- Wat zijn mijn vooruitzichten en levensverwachting?
- Hoe vaak moet ik naar het ziekenhuis komen en hoe lang moet ik daar zijn?
- Hoeveel tijd heb ik om na te denken over wat ik wil?
-
Behandeling met stamceltransplantatie
-
Behandeling zonder stamceltransplantatie
-
Behandeling als de ziekte terugkomt
-
Groepen medicijnen voor multipel myeloom
-
Bijwerkingen
-
Ondersteunende behandelingen
-
Medische ontwikkelingen
Behandeling met stamceltransplantatie
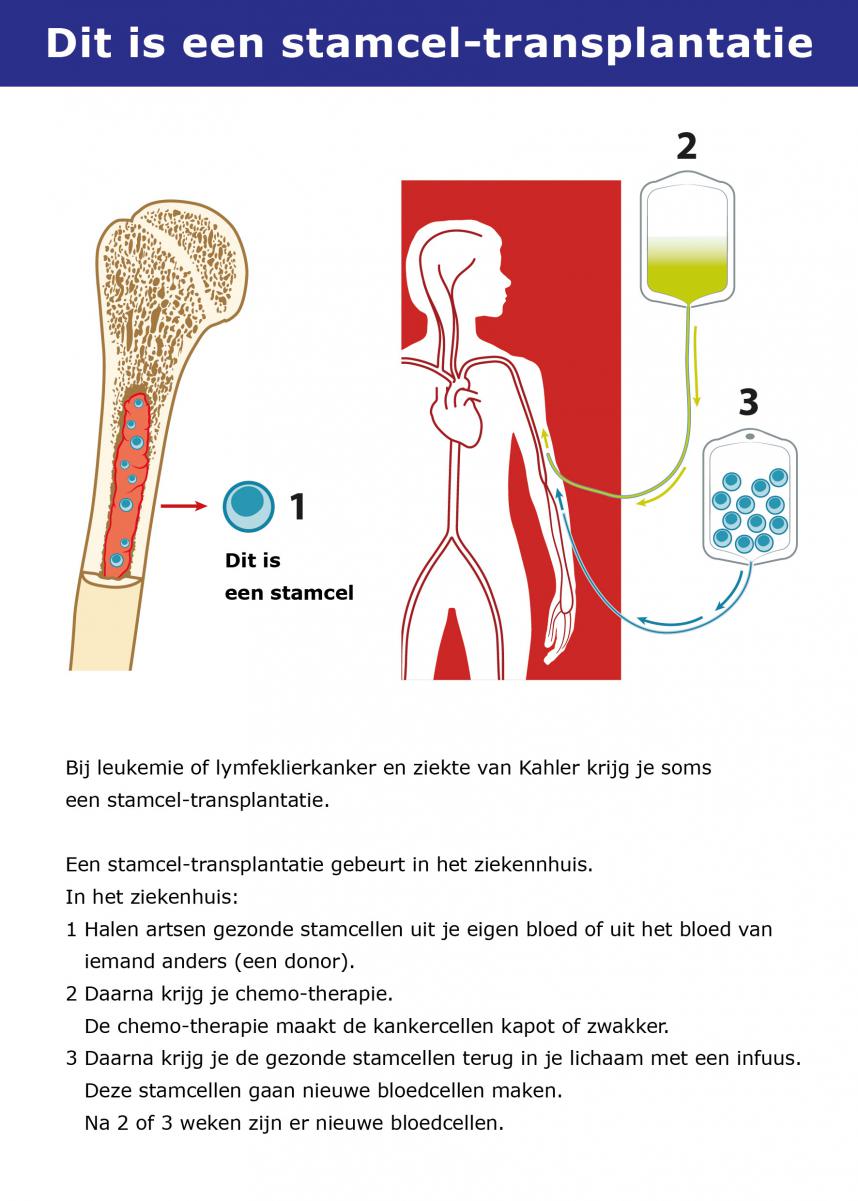
Als je conditie goed genoeg is, is een autologe stamceltransplantatie de standaard eerstelijnsbehandeling bij de ziekte van Kahler. Hierbij krijg je een stamceltransplantatie met je eigen stamcellen.
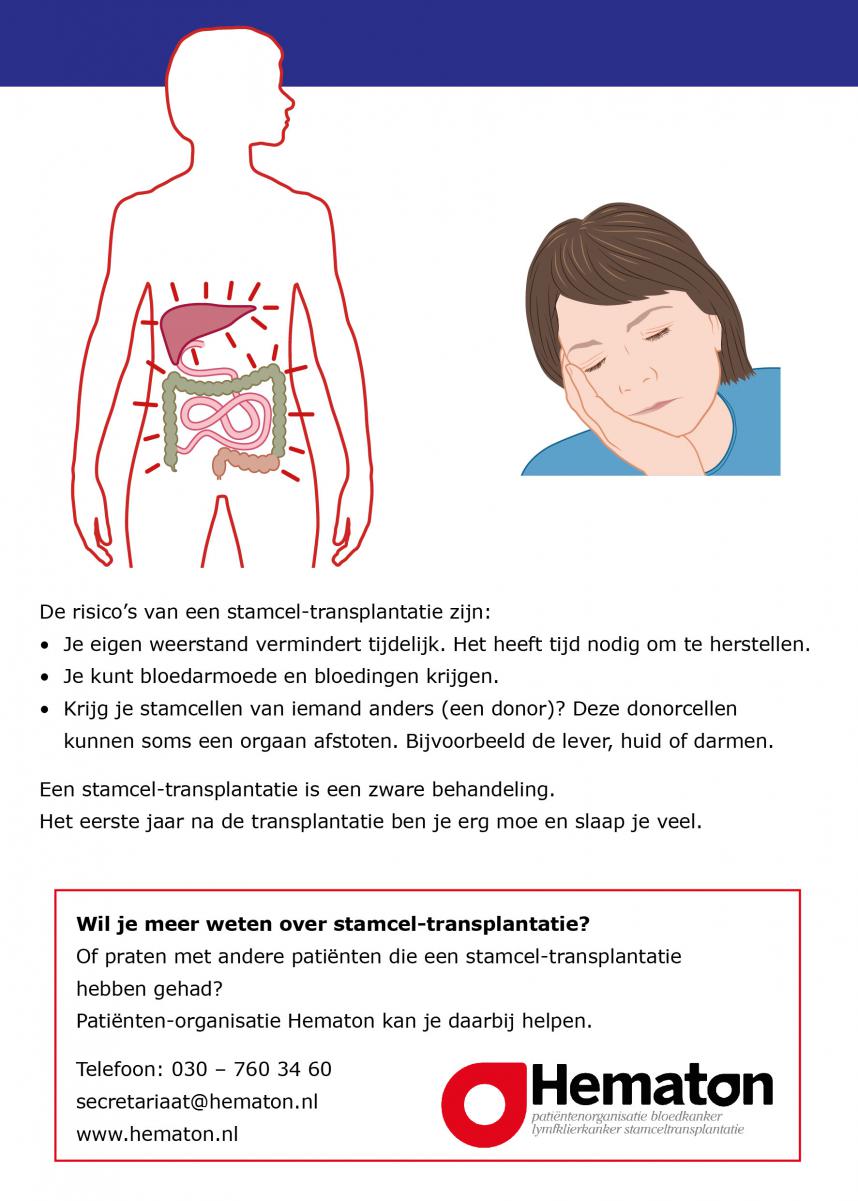
Het doel is om alle kwaadaardige plasmacellen te doden en te vervangen door gezonde plasmacellen. De bijwerkingen van een autologe stamceltransplantatie zijn relatief zwaar, waardoor mensen die ouder zijn dan 70 jaar vaak niet aanmerking komen. Ook als je jonger bent dan 70 jaar, maar je conditie niet goed genoeg is, kun je deze behandeling niet ondergaan. De leeftijdsgrens ligt bij 70 jaar, maar er worden wel eens stamceltransplantaties uitgevoerd bij mensen boven de 70 jaar, als ze fit genoeg zijn.
De behandeling bestaat uit verschillende delen, welke hieronder kort worden samengevat. Kijk voor meer informatie over autologe stamceltransplantatie hier.
- Inductietherapie: Als eerste krijg je een behandeling met een combinatie van 3 of 4 medicijnen tegelijkertijd om de ziekte onder controle te krijgen. Dit wordt bepaald aan de hand van de hoeveelheid M-proteïne in je bloed en urine. Deze waardes moeten significant afnemen voordat doorgegaan wordt met de volgende stap. De beste resultaten worden gezien met een combinatie van daratumumab, bortezomib, thalidomide en dexamethason (Dara-VTD). Deze medicijnen doden de kwaadaardige plasmacellen of zorgen ervoor dat je eigen afweersysteem geactiveerd wordt en de plasmacellen opruimt.
- Stamcelmobilisatie: Vervolgens krijg je een behandeling om de gezonde stamcellen in ons beenmerg naar het bloed te laten gaan, zodat ze er makkelijk uitgefilterd kunnen worden. Eerst krijg je een hoge dosis van de chemotherapie cyclofosfamide, om de zieke plasmacellen te vernietigen. Dit wordt gevolgd door injecties met de groeifactor G-CSF, dat ervoor zorgt dat er snel extra stamcellen worden aangemaakt.
- Oogsten van de stamcellen: Als er voldoende stamcellen in het bloed zijn, worden de stamcellen geoogst. Dat gebeurt met een leukaferese-apparaat. Hiervoor wordt er in beide armen een infuus geplaatst en aangesloten op het apparaat. Via één van de infusen gaat je bloed naar de leukaferese machine, waar de stamcellen uit het bloed gefilterd worden. De rest van het bloed krijg je weer terug via het andere infuus. Dit duurt ongeveer 4 tot 6 uur. De geoogste stamcellen worden vervolgens ingevroren tot dat ze gebruikt gaan worden.
- Conditioneringstherapie: Na het oogsten van de stamcellen wordt de transplantatie gepland. Voordat de transplantatie plaatsvindt krijg je een intensieve chemokuur met het middel melfalan. Dit heeft als doel om de nog aanwezige kankercellen te vernietigen. Helaas wordt ook een groot deel van het gezonde beenmerg vernietigd door de hoge dosis melfalan.
- Stamceltransplantatie: Kort na de chemokuur krijg je de eerder geoogste stamcellen terug via een infuus. Via het bloed gaan deze stamcellen naar het beenmerg, waar ze zich nestelen en nieuwe bloed- en beenmergcellen aan gaan maken. Ongeveer 2 tot 3 weken later is er weer een normale hoeveelheid bloedcellen in je lichaam. Deze periode wordt de dip genoemd, waarbij je verschillende klachten kunt hebben, zoals pijn in de mond, diarree en vatbaarheid voor infecties.
- Consolidatietherapie: Na de stamceltransplantatie worden in het algemeen nog 2 kuren met daratumumab, bortezomib, thalidomide en dexamethason gegeven. Het doel hiervan is om achtergebleven kankercellen te doden en de kans op terugkeer van de ziekte te verkleinen.
- Onderhoudstherapie: Nadat je hersteld bent van de stamceltransplantatie en je weer voldoende cellen in je bloed hebt, wordt geadviseerd om een onderhoudsbehandeling met lenalidomide te volgen. Onderzoek laat zien dat bij mensen die de onderhoudstherapie krijgen de ziekte twee keer zo lang wegblijft als bij mensen die geen onderhoudstherapie krijgen.
Als er bij het chromosoomonderzoek van de plasmacellen ongunstige kenmerken gevonden zijn, dan wordt er geadviseerd om een tweede autologe stamceltransplantatie te ondergaan. De tweede transplantatie vindt ongeveer twee tot drie maanden na de eerste stamceltransplantatie plaats.
Behandeling zonder stamceltransplantatie
Voor oudere en/of niet fitte mensen met multipel myeloom, voor wie een stamceltransplantatie te zwaar is, bestaat de behandeling uit therapie met een combinatie van verschillende middelen. Welke combinatie je krijgt hangt af van verschillende factoren, waaronder hoe fit je bent en of je bepaalde kenmerken of andere ziektes hebt. Hierdoor kan de ene combinatie van middelen beter geschikt zijn dan een andere. Je arts kan je uitleggen waarom voor een bepaalde combinatie wordt gekozen, dus vraag hiernaar als het niet duidelijk is.
Bij voorkeur wordt er gekozen voor één van de volgende drie combinaties:
- Dara-Rd: daratumumab in combinatie met lenalidomide en dexamethason. De verwachte mediane progressievrije overleving is meer dan 50 maanden. Dit betekent dat bij ongeveer de helft van de mensen die deze behandeling krijgen de ziekte langer dan 50 maanden stabiel is, terwijl bij de andere helft de ziekte korter dan 50 maanden stabiel is.
- Dara-MPV: daratumumab met melfalan, prednison en bortezomib. De verwachte mediane progressievrije overleving is 36 maanden.
- VRd: bortezomib, lenalidomide en dexamethason. De verwachte mediane progressievrije overleving is 43 maanden (met de kanttekening dat in de studie waarin dit gemeten is ook veel jonge patiënten zaten, waardoor de verwachting iets hoger uitvalt).
Alternatieve combinaties die milder zijn, maar ook minder effectief:
- MPV: melfalan met prednison en bortezomib. De verwachte mediane progressievrije overleving is ongeveer 19 maanden.
- Rd: lenalidomide met dexamethason. De verwachte mediane progressievrije overleving is 32 maanden.
Behandeling als de ziekte terugkomt
Helaas is multipel myeloom niet te genezen en kan de ziekte terugkomen. In dat geval zijn er veel andere behandelingen. Er zijn verschillende groepen behandelingen, en binnen die groepen zijn er weer verschillende medicijnen. Deze werken allemaal net iets anders en kennen ook andere bijwerkingen.
Zelfs als een medicijn binnen een groep niet meer werkt, kan een ander medicijn binnen die groep nog wel goed werken.
In het algemeen wordt aangeraden om bij terugkerende ziekte te kiezen voor een middel met een andere manier van werken. Maar soms wordt er juist voor hetzelfde middel of dezelfde behandeling gekozen, als de respons goed en langdurig is geweest. Bij mensen die bijvoorbeeld minimaal 2 tot 3 jaar na een autologe stamceltransplantatie geen verschijnselen van de ziekte van Kahler laten zien kan een tweede autologe stamceltransplantatie gegeven worden. Tijdens de stamcelmobilisatie en het oogsten voor de eerste stamceltransplantatie worden er zoveel mogelijk stamcellen verzameld. Als het er genoeg zijn, wordt de helft gebruikt en de andere helft bewaard voor een eventuele tweede autologe stamceltransplantatie.
Door de vele soorten behandelingen is de ziekte van Kahler vaak een chronische ziekte, waarbij het mogelijk is dat je lang kunt leven. Ook komen er steeds meer nieuwe behandelingen bij en lopen er klinische studies om nieuwe behandelingen te testen. Hierdoor heb je telkens als een behandeling bij jou niet meer werkt veel mogelijkheden voor een volgende behandeling. Samen met je arts bepaal je wat de volgende stappen zijn. Deze keuzes worden gemaakt op basis van de resultaten van je eerdere behandeling, mogelijke bijwerkingen, je fitheid, bijkomende ziekten zoals hart- en vaatziekten, diabetes en andere aandoeningen. Ook wordt een onderscheid gemaakt tussen of je nog goed reageert op lenalidomide en/of daratumumab of niet. Als laatste worden ook je eigen wensen en voorkeur hierin meegenomen.
Groepen medicijnen voor multipel myeloom
- Groep 1 - Klassieke chemotherapie.
Deze medicijnen remmen de celdeling en leiden zo tot de dood van de kwaadaardige plasmacellen. Hiertoe behoren melfalan en cyclofosfamide. - Groep 2 - Proteasoom remmers.
Deze middelen remmen het proteasoom, de afvalverwerkingsplaats in de cel. Door het remmen van het proteasoom hopen er afvalstoffen op, waardoor de cel doodgaat. Hiertoe behoren bortezomib, ixazomib en carfilzomib. - Groep 3 - IMiDs (de immuunmodulatoire middelen).
Een IMiD versterkt en activeert de afweercellen in het beenmerg zodat zij vervolgens de kwaadaardige plasmacellen gaan doden. Hiertoe behoren thalidomide, lenalidomide, pomalidomide en iberdomide. - Groep 4 – Antistoftherapie.
De antistoffen herkennen een kenmerk op het oppervlakte van kwaadaardige plasmacellen. Na binding van de antistof aan het oppervlakte maakt het de plasmacel op een directe manier dood, maar het trekt ook nog afweercellen aan die de plasmacellen nog effectiever doden en opruimen. Hiertoe behoren daratumumab, isatuximab en elotuzumab.
Bijwerkingen
De verschillende medicijnen die gebruikt kunnen worden bij de behandeling hebben elk hun eigen bijwerkingen. Niet iedereen krijgt deze bijwerkingen. Ook de ernst van de bijwerkingen wisselt per persoon. Soms zijn de bijwerkingen van een bepaald middel zo heftig dat het nodig is om de behandeling aan te passen. Meld je bijwerkingen daarom altijd!
- Er zijn vaak goede mogelijkheden om je bijwerkingen te verlichten.
- Als je bijwerkingen niet meldt, kan dit zorgen voor blijvende schade die vervolgbehandelingen in de weg staan.
- Wees niet bang bijwerkingen te melden omdat je denkt dat de therapie gestopt gaat worden. Dat is niet altijd nodig. Als het wel nodig is, zijn er meestal andere vormen van therapie die ook goed werken.
Verschillende bijwerkingen die kunnen voorkomen tijdens de behandelingen en wat hiertegen gedaan kan worden:
- Neuropathie: dit is een beschadiging aan je zenuwen, wat pijn, tintelingen of andere klachten tot gevolg heeft. Het is een bekende bijwerking van bortezomib en thalidomide. Lees hier meer over neuropathie.
- Trombose: sommige behandelingen verhogen het risico op trombose. Aspirine of antistollingsmiddelen kunnen worden gegeven om dit risico te verlagen.
- Gevoeligheid voor infecties: er kan een tekort aan goed werkende witte bloedcellen ontstaan doordat de normale productie van bloedcellen verstoord is door de ophoping van kwaadaardige plasmacellen in het beenmerg of door medicijnen die naast de kankercellen ook gezonde cellen in het beenmerg doden. Hierdoor heb je een lagere weerstand tegen ziekteverwekkers. Je kunt antibiotica krijgen om infecties met bacteriën te voorkomen of behandelen, en een virusremmer zoals valaciclovir om infecties met virussen (oa gordelroos) te voorkomen of te behandelen.
- Bloedarmoede: er kan een tekort aan rode bloedcellen ontstaan doordat de normale productie van bloedcellen verstoord is door de ophoping van kwaadaardige plasmacellen in het beenmerg of door medicijnen die naast de kankercellen ook gezonde cellen in het beenmerg doden. Je kunt bloedtransfusies of erythropoiëtine (EPO) krijgen om het aantal rode bloedcellen te verhogen.
Ondersteunende behandelingen
Ook kan er ondersteunde behandeling gegeven worden tegen verschijnselen die optreden door de ziekte van Kahler.
- De verhoogde botafbraak en bijbehorende toename van calcium in het bloed kan worden geremd met bifosfonaten, zoals zoledroninezuur of alendroninezuur (ADP of zometa). Eén van de (zeldzame) bijwerkingen van deze medicijnen is een ontsteking van het kaakbot. De kans hierop wordt groter als je een ingreep aan het gebit ondergaat. Daarom moet je altijd melden dat je bifosfonaten gebruikt als je bij de tandarts bent.
- Pijn in de botten of druk op de zenuwen of het ruggenmerg kan worden behandeld door bestraling. Bestraling wordt hierbij gebruikt als pijnbestrijding of om schade aan zenuwen of het ruggenmerg te voorkomen.
- Nierproblemen kunnen ontstaan door de vrije lichte ketens die de werking van de nier verminderen en verhoogde hoeveelheden calcium in het bloed door botafbraak. Bij ernstige nierproblemen kan dialyse nodig zijn.
Iedere behandeling is ingrijpend. Contact met lotgenoten en informatie inwinnen over de impact van de behandeling kan helpen om je beter voor te bereiden op de behandeling.
Medische ontwikkelingen
Door wetenschappelijk onderzoek is er de laatste jaren veel nieuwe informatie beschikbaar gekomen over multipel myeloom, waardoor er veel nieuwe medicijnen en behandelingen worden onderzocht.
Vooral op het gebied van immuuntherapie is er veel onderzoek, waardoor er nieuwe vormen van immuuntherapie tegen de ziekte van Kahler zijn. Met nieuwe vormen van immuuntherapie bedoelen we behandelingen die nog niet geregistreerd zijn en daarom ook nog niet worden vergoed. Deze behandelingen zijn effectief en daarom is registratie wel te verwachten in de toekomst.
CAR-T cellen
Door deze behandeling worden je eigen afweercellen beter gemaakt in het opsporen en doden van kwaadaardige plasmacellen.
Bepaalde afweercellen (T-cellen) worden uit je lichaam gehaald en buiten het lichaam in het laboratorium voorzien van een antenne die de kwaadaardige plasmacel herkent. Deze antenne wordt een chimere antigeen receptor (CAR) genoemd, en kan zich specifiek binden aan een eiwit dat op de buitenkant van de kwaadaardige plasmacellen zit. Hierdoor zijn T-cellen beter in het herkennen, binden aan, en doden van de kwaadaardige plasmacellen. Door middel van een infuus krijg je je eigen T-cellen met deze antenne weer terug, waarna ze hun werk kunnen uitvoeren.
Bi-specifieke antistoffen
Bij deze doelgerichte immuuntherapie krijg je bi-specifieke antistoffen. Deze kunnen gelijktijdig twee verschillende cellen herkennen. Aan de ene kant kan een kenmerk van de kwaadaardige plasmacellen herkend en gebonden worden, aan de andere kant een kenmerk op de T-cel. Zo wordt de T-cel bij de kwaadaardige plasmacel gebracht, waardoor ze effectiever zijn in het doden van de plasmacellen.
Hieronder staat een interview met Niels van de Donk, hematoloog, en Sebastiaan Zuidweg, patiënt met multipel myeloom, over de behandeling met bi-specifieke antilichamen.
Behandeling specifiek voor bepaalde mutaties
Er wordt onderzoek gedaan naar medicijnen die werken bij patiënten met specifieke mutaties of medicijnen die zich richten op specifieke eiwitten. We beschrijven hieronder enkele voorbeelden. Er worden echter veel verschillende behandelingen onderzocht, dus deze lijst is niet volledig.
- BRAF remmers: Ongeveer 5 procent van de mensen met de ziekte van Kahler hebben een mutatie die BRAF wordt genoemd. Als deze mutatie gevonden wordt, kun je bijvoorbeeld behandeld worden met de BRAF remmer vermurafenib en dabrafenib.
- MDM2 remmers: Het eiwit MDM2 speelt een belangrijke rol bij het delen en de overleving van kwaadaardige plasmacellen. Door MDM2 te remmen, zijn de plasmacellen minder goed in staat om zich te delen en gaan ze sneller dood. Deze behandeling kan worden gegeven bij patiënten met de del(17p) mutatie. De remmer DS-3032b wordt onderzocht in klinische trials.
- FGFR3 en MMSET remmers: Mensen met de t(4;14) mutatie kunnen mogelijk worden behandeld met FGFR3 remmers (erdafitinib) en MMSET remmers (KTX-1001), dit wordt onderzocht in klinische trials. FGFR3 en MMSET zijn bepaalde eiwitten die verhoogd kunnen zijn in multipel myeloom en ze kunnen bijdragen aan ongecontroleerde celdeling van de kwaadaardige plasmacellen.
Laatste nieuws over multipel myeloom
 Myeloom
MyeloomGeneesmiddel voor multipel myeloom niet vergoed
Het ministerie van VWS heeft besloten een... Myeloom
Myeloom45 procent daling inkomen als je kahler krijgt
Uit onderzoek van Erasmus MC is gebleken dat... Myeloom
Myeloom16 miljoen voor onderzoek multipel myeloom
Dankzij een particuliere sponsor kan Amsterdam...